Содержание статьи
Опубликовано в «Ангиология и сосудистая хирургия» том 12 № 2 / 2006
С. А. Капранов, Б. Ю. Бобров
Федеральный центр рентгенохирургии МЗ РФ, Москва, Россия
Работа посвящена анализу технических и анатомических факторов, влияющих на эффективность эмболизации маточных артерий (ЭМА) при лечении больных миомой матки.
На опыте 420 вмешательств авторы выявили, что причинами неэффективности ЭМА являются:
Определено значение маточно-яичниковых артериальных анастомозов в кровоснабжении миоматозных узлов, предложены технические приемы, позволяющие добиваться адекватной эмболизации при их наличии. Технические и анатомические факторы играют решающую роль в успешности ЭМА. При неэффективности ЭМА, связанной с восстановлением или сохранением кровоснабжения миоматозных узлов, необходимо выполнение повторного вмешательства.

В последние 3 года в повседневную практику отечественного здравоохранения входит органосохраняющий эндоваскулярный метод лечения миомы матки — эмболизация маточных артерий (ЭМА).
В настоящее время первоначальный период скептического отношения гинекологов и эндоваскулярных хирургов к этому методу сменяется периодом активного внедрения ЭМА в практику большинства ведущих лечебных учреждений России. Тем не менее, в большинстве клиник опыт подобных вмешательств мал, не превышает 100 наблюдений; практически отсутствуют собственные данные об отдаленных результатах лечения. Несмотря на это, относительная простота классической методики эмболизации и первые обнадеживающие результаты ее применения в нашей стране [1-3] создают ложное впечатление о том, что ЭМА стала рутинной методикой, что «все уже известно».
Анализ ближайших и отдаленных результатов более 400 ЭМА, выполненных в нашем Центре показал, что многие вопросы требуют своего решения. Это преимущественно гинекологические вопросы, в частности, влияние ЭМА на функцию яичников, особенности беременности и родов после ЭМА, сравнение эффективности ЭМА и консервативной миомэктомии, ведение больных с экспульсией субмукозных узлов и т. д. Но ряд проблем относится в первую очередь к компетенции эндоваскулярных хирургов — прежде всего это вопросы неэффективности ЭМА, связанной с сохранением или восстановлением кровоснабжения миоматозных узлов.
С октября 2002 г. по май 2005 г. эмболизация маточных артерий была выполнена 420 пациенткам, имевшим миому матки, в возрасте от 21 года до 56 лет. По данным комплексного клинико-инструментального обследования, локализация лидирующего миоматозного узла у 124 больных (29,5%) была субсерозно-интерстициальной, у 257 (61,2%) — субмукозно-интерстициальной и у 39 (9,3%) — интрамуральной. У 65% больных миома была множественна: имелось от 2 до 10 (в среднем 2,9) узлов. В 67 случаях (16%) миома располагалась в шеечно-перешеечной части матки. Основным клиническим проявлением миомы в 231 наблюдениях (55%) была менометроррагия, сопровождающаяся хронической железодефицитной анемией у 121 из них. В 73 случаях (17,4%) наблюдались симптомы сдавления смежных органов, в 31 (7,4%) — диспа- реуния и лишь у 37 пациенток (8,8%) миома была бессимптомной. Следует подчеркнуть, что 68 паци- енток (16,2%) страдали от бесплодия, связанного с наличием миомы матки.
Для вмешательства использовали традиционную методику трансфеморальной катетеризации обеих маточных артерий формированием петли Волтмана катетерами Robert’s (William Cook Europe, Denmark), Cobra, JR (Cordis, USA) 4 Fr, с применением гидрофильных проводников Terumo (Japan) 0,035» и введением частиц поливинилалкоголя Trufill (Cordis, USA) или PVA (William Cook Europe, Denmark) с размерами частиц в 300 — 500 и 500 — 700 мкр.
В 418 наблюдениях выполняли двустороннюю эмболизацию маточных артерий. В двух случаях (0,4%) эмболизация была односторонней из-за технической неудачи катетеризации правой маточной артерии у одной больной и отказа от эмболизации левой маточной артерии в связи с наличием маточно-яичникового артериального анастомоза типа II у другой пациентки, заинтересованной в беременности. Двусторонняя пункция бедренной артерии потребовалась только в 3 наблюдениях (0,7%) на ранних этапах освоения методики. ЭМА занимала от 5 до 140 (в среднем 17) мин. Время рентгеноскопии колебалось в пределах 2 — 45 (в среднем 5,2) мин. Объем вводимого контрастного вещества составлял 50 — 250 (в среднем 65) мл. У 52% больных имелись варианты кровоснабжения матки и яичников.
Результаты ЭМА прослежены в сроки от 1 до 30 (в среднем 12,1) месяцев. Через 1,5 года после эндоваскулярного вмешательства было отмечено уменьшение размеров миоматозных узлов в среднем с 11,4 до 2,6 см, а матки с 13,6 недель беременности до нормальных размеров. У 401 больной (95,2%) были полностью устранены или значительно уменьшены клинические симптомы миомы матки. 98,7% пациенток высказали полную удовлетворенность произведенной ЭМА. У 15 больных (3,5%) ЭМА оказалась неэффективной, что проявилось возобновлением или сохранением клинических симптомов миомы матки.
Мы выявили, что причинами неэффективных ЭМА были:
В сроки от одних суток до 12 месяцев у 14 из них (93,4%) выполнены повторные вмешательства, которые в 10 наблюдениях (71,4%) привели к необходимому клиническому эффекту.
Техническая неудача. Невозможность выполнения катетеризации и эмболизации даже одной из маточных артерий большинством авторов расценивается как техническая неудача. Самой частой причиной этого является отхождение маточной артерии от внутренней подвздошной артерии под прямым или тупым углом. По нашим данным, такие варианты анатомии встречаются у 4,8% больных, причем, почти у 1/3 из них с двух сторон.
Как правило, в такой ситуации катетеризация устья маточной артерии при помощи стандартно используемых катетеров Cobra, JR, Roberts затруднительна. В подобных случаях мы считаем целесообразным применять модифицированный катетер Roberts, разработанный нами и имеющий большую кривизну дистального конца. Как правило, такая конфигурация катетера позволяет ввести проводник, а затем и сам катетер в самых сложных ситуациях.
Еще одним вариантом анатомии, затрудняющим катетеризацию, является выраженная извитость проксимального отрезка маточной артерии (Рис. 1). Если извитость дистального отдела маточной артерии, относительно свободно лежащего в параметрии, легко расправляется введением гидрофильного проводника, то расправить изгибы в ее проксимальной части значительно сложнее. Если попытки катетеризации оказываются неуспешными, целесообразно использовать гидрофильный микрокатетер и выполнять эмболизацию уже через него.
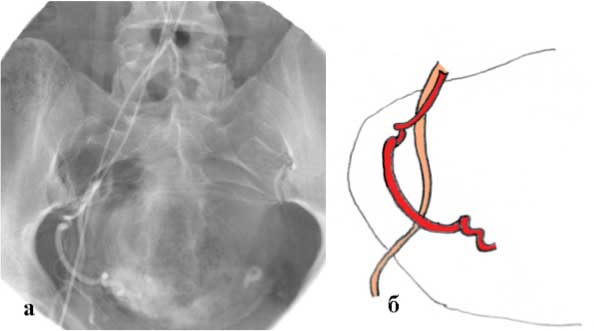
Рис. 1 а, б. Выраженная извитость проксимального отрезка маточной артерии: а — ангиограмма; б —схематическое изображение.
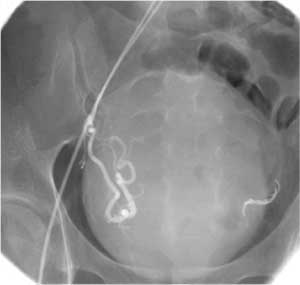
Рис. 2 а, б. Спазм ствола маточной артерии:
резкий изгиб левой маточной артерии у устья
Большие трудности создает спазм ствола маточной артерии (Рис. 2). Спазм проксимального отдела препятствует катетеризации артерии, а спазм, возникающий в дистальных отделах, создает риск агрегации частиц эмболизирующего препарата в зоне спазма. Перифиброидное сплетение в этом случае остается неэмболизированным, а само вмешательство незавершенным.
Для устранения спазма рекомендуется ввести в маточную артерию 5 — 10 мл 0,1%-ного раствора папаверина и выждать в течение 5 — 7 мин. Важно отметить, что по данным Keyong J. A. et al. [4], введение лидокаина, который чаще всего применяется в эндоваскулярной хирургии с целью устранения артериального спазма, оказывается неэффективным. Более того, по их данным, лидокаин способен усилить выраженность спазма. В связи с этим введение лидокаина в маточные артерии является нежелательным. Если спазм не разрешается, целесообразно перейти к эмболизации контралатеральной маточной артерии (если она еще не выполнялась).
Возможным вариантом эмболизации маточной артерии в условиях неразрешающегося спазма является введение эмболизационного препарата с частицами меньшего калибра (150 — 355 нм), которые могут беспрепятственно преодолеть зону спазма. Еще одна возможность успешного выполнения процедуры связана с проведением через зону спазма гидрофильного микрокатетера. Важно отметить, что попытка проведения через спазмированный участок обычного катетера 4 — 5 °F на проводнике с высокой вероятностью закончится диссекцией интимы и тромбозом маточной артерии. Поскольку спазм маточной артерии может существенно затруднить выполнение ЭМА, необходимо принимать все меры для его профилактики. Для этого перед вмешательством необходимо назначать больным адекватную седацию, уделяя особое внимание эмоционально лабильным пациентам. В ходе вмешательства важно избегать резких манипуляций проводником и катетером во внутренней подвздошной артерии и ее ветвях. Помимо этого крайне желательно использовать неионные контрастные вещества, обладающие значительно меньшим раздражающим действием по сравнению с ионными.
Указанные выше технические приемы позволяют минимизировать частоту технически неуспешных попыток ЭМА. В наших наблюдениях из 420 больных, которым выполнялась ЭМА, лишь в 2 случаях (0,5%) не удалось катетеризировать одну из маточных артерий.
Под неполной эмболизацией мы понимаем ситуацию, когда после введения эмболизационного препарата в обе маточные артерии сохраняется кровоснабжение перифиброидного сплетения или его части. Наиболее частыми причинами неполной эмболизации являются:
Оценка «конечной точки» является одним из ключевых аспектов ЭМА. В зависимости от используемого препарата критерии адекватной эмболизации несколько различаются. Частицы PVA следует вводить до остановки кровотока в стволе маточной артерии (так называемая «эмболизация до стаза»). Имеется несколько рентгенологических признаков адекватной эмболизации:
В ряде случаев при погрешностях техники может возникать ложная ангиографическая картина закупорки маточных артерий — «псевдоэмболизация». Основной ее причиной является так называемый «бифуркационный эффект», который заключается в агрегации частиц препарата в проксимальных ветвях маточной артерии непосредственно после его введения, что создает ангио- графичекую картину корректной «конечной точки». Однако через несколько минут происходит его периферическая миграция, в ходе которой возможно частичное восстановление кровотока в ветвях перифиброидного сплетения (Рис. 7, 8).
Причинами этого феномена являются:
Во избежание возникновения бифуркационного эффекта некоторые авторы рекомендуют выполнять контрольную ангиографию маточных артерий спустя 5-10 мин после эмболизации [5].
Довольно часто причиной неэффективной эмболизации является наличие особенностей кровоснабжения матки и яичников. Мы наблюдали различные варианты кровоснабжения у 52% больных, которым выполнялась ЭМА. В большинстве случаев они были представлены маточно-яичниковыми артериальными анастомозами. Мы выделяли три типа анастомозов:
По нашим данным, низкая эффективность ЭМА за счет сохранения кровоснабжения узлов отмечается у 22% больных с типами анастомозов Ia и III, а у 5,2% больных эффект от вмешательства полностью отсутствовал. Причиной неполной эмболизации, как правило, становится наличие анастомозов типа Iа (редко типа Ib) и типа III. В первом случае частицы эмболизата могут не достигать периферических разветвлений маточной артерии в зоне анастомоза за счет их «смывания» потоком крови из яичниковой артерии.
В такой ситуации возможно применить введение эмболизирующего препарата под давлением с забросом в яичниковую артерию. Однако, при этом возникает риск непреднамеренной эмболизации артерии. При наличии анастомоза типа III часть миоматозного узла кровоснабжается преимущественно ветвями яичниковой артерии. По мнению Worting- ton-Kirsh R., такой тип кровоснабжения чаще всего имеется при миоме больших размеров, когда дно матки достигает уровня пупка [6]. Неприятной особенностью этого варианта кровоснабжения является то, что его не всегда удается выявить при ангиографии маточный артерий, поскольку непосредственное анастомозирование их ветвей может отсутствовать. В такой ситуации особую важность приобретает качественное предоперационное ультразвуковое исследование с обязательным ангиосканированием маточных и яичниковых артерий, а также их ветвей. В связи с этим важно, чтобы эндоваскулярный хирург, выполняющий эмболизацию, имел детальное представление о размерах и топографии миоматозных узлов.
Если при контрастировании маточных артерий определяется несоответствие топографии их ветвей и предполагаемого перифиброидного сплетения, следует предположить наличие яичникового кровоснабжения миоматозного узла (тип III). В такой ситуации целесообразно сразу же после эмболизации маточных артерий перейти к брюшной аортографии или непосредственному зондированию яичниковых артерий. Как правило, яичниковые артерии отходят по передне-боковой стенке аорты чуть ниже устьев почечных артерий. Иногда они отходят от почечных артерий, в связи с чем при выполнении брюшной аортографии целесообразно устанавливать катетер чуть выше почечных артерий.
Если аортография или ангиография яичниковых артерий подтверждает их участие в кровоснабжении перифиброидного сплетения, возможно несколько вариантов тактики вмешательства:
Чаще всего восстановление кровоснабжения возникает при неполной эмболизации, о чем уже говорилось выше. Однако в редких случаях мы наблюдали восстановление кровоснабжения миоматозных узлов из ветвей, не принимавших до этого участия в кровоснабжении матки: в одном случае источником являлась ветвь пузырной артерии, в другом — ветвь правой внутренней срамной артерии, анастомозирующая с левой яичниковой артерией (Рис. 10). Патогенез этого феномена не вполне ясен. Не исключено, что его предпосылкой может быть изначальное наличие анастомозов этих ветвей и ветвей перифиброидного сплетения. Тем не менее, в обоих случаях восстанавливалось кровоснабжение небольшого участка перифиброидного сплетения, что большого клинического значения не имело.
Накопленный нами опыт ЭМА позволяет сделать вывод о том, что технические и анатомические факторы играют решающую роль в успешности эмболизации при лечении больных миомой матки. Нарушения техники вмешательства, неправильная оценка «конечной точки» часто могут быть причиной неэффективности ЭМА.
В то же время слепое тиражирование стандартного подхода при наличии особенностей кровоснабжения матки и яичников может приводить не только к неэффективности вмешательства, но и к возникновению его нежелательных осложнений, существенно влияющих на качество жизни больных и их фертильность. В большинстве ситуаций неэффективность ЭМА, связанная с восстановлением или сохранением кровоснабжения миоматозных узлов, является прямым показанием к выполнению повторного вмешательства. В наших наблюдениях эффективность повторных вмешательств составила 71,4%.
Мы убеждены, что для достижения оптимального результата роль эндоваскулярного хирурга не должна ограничиваться только механическим выполнением самой эмболизации. Напротив, по-нашему мнению, залогом высокой эффективности лечения является тесное сотрудничество гинекологов и эндоваскулярных хирургов, как на этапе предоперационного обследования и отбора больных, так и в отдаленном периоде при анализе результатов вмешательства.
Список литературы:
Ведущие специалисты
Наши услуги
Регистрация