Содержание статьи
Опубликовано в «Диагностическая и интервенционная радиология» том 1 № 2 / 2007. Часть II: методические аспекты
Б. Ю. Бобров, С. А. Капранов, В. Г. Бреусенко, Ю. Э. Доброхотова, И. А. Краснова, В. Б. Аксенова, Д. Г. Арютин
Кафедра факультетской хирургии лечебного факультета, Кафедры акушерства и гинекологии лечебного и московского факультетов, Проблемная научно-исследовательская лаборатория внутрисердечных и контрастных методов рентгеновских исследований ГОУ ВПО РГМУ Росздрава, Москва
В статье приведены подробные методические детали и технические аспекты эмболизации маточных артерий, имеющие важное значение для успешного выполнения и обеспечения безопасности вмешательства. Приведено подробное описание ренгеноанатомии внутренних подвздошных артерий, различных вариантов кровоснабжения матки и яичников, типов анастомозирования между маточными и яичниковыми артериями. Описаны технические приемы, способствующие успешному выполнению эмболизации маточных артерий при наличии сложных анатомических вариантов и особенностей строения маточных артерий.
Эмболизация маточных артерий (ЭМА) представляет собой довольно сложное эндоваскулярное вмешательство. Технические и тактические ошибки при ее выполнении могут не только снизить клиническую результативность ЭМА, но и привести к серьезным осложнениям, чреватым нарушением репродуктивной функции женщины и даже потерей матки. В этой публикации мы хотели бы остановиться на наиболее важных особенностях методики ЭМА, возможных технических сложностях и нюансах вмешательства, возникающих при наличии вариантов кровоснабжения матки и яичников.
При выполнении ЭМА одним из залогов успеха является знание анатомических особенностей деления внутренней подвздошной артерии на ветви, участвующие в приоритетном кровоснабжении различных органов малого таза и, в частности, матки (рис. 1).

Рис. 1. Ангиограмма внутренней подвздошной артерии и схематическое изображение ее ветвей (пояснения в тексте)
Внутренняя подвздошная артерия, начавшись от нижнего конца общей подвздошной артерии, на уровне верхнего края большого седалищного отверстия делится на два основных ствола: передний и задний.
Задний ствол дает всего три ветви:
От переднего ствола отходят все остальные ветви:
Наиболее крупными ветвями внутренней подвздошной артерии, отчетливо дифференцирующимися на ангиограммах, как правило, являются верхняя и нижняя ягодичные, запирательная, внутренняя срамная, верхняя пузырная и маточная артерии [1].
Приоритетное кровоснабжение яичников осуществляется, главным образом, за счет одноименных артерий (a. ovarica), и из ветвей маточной артерии (ramus ovaricus et ramus tubarius).
Яичниковые артерии отходят от аорты по ее передней поверхности тотчас ниже устьев почечных артерий (рис. 2, а, б, в), а в некоторых случаях — и от самих почечных артерий.
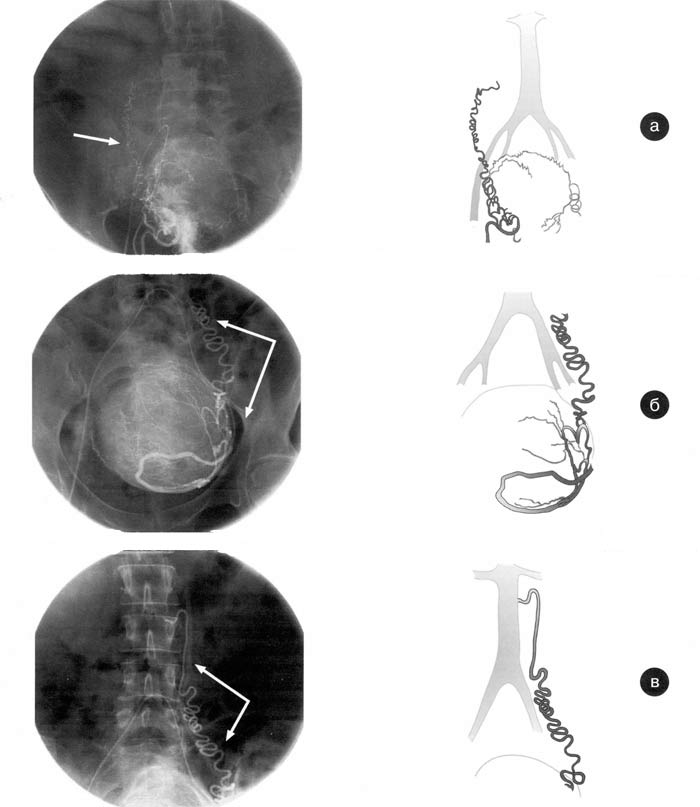
Рис. 2. Яичниковые артерии а) - правая (стрелка) и б), в) - левая (двойная стрелка), анастомозирующие с маточными артериями
У многих пациенток яичниковая и трубная ветви маточной артерии являются основными сосудами, питающими придатки, которые зачастую в области ворот яичника имеют намного больший диаметр по сравнению с рудиментарными яичниковыми артериями. В редких случаях ветви маточной артерии являются единственным источником кровоснабжения яичника (рис. 3). При этом собственно яичниковая артерия отсутствует.
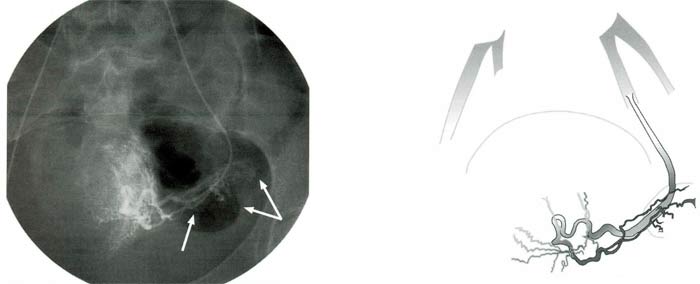
Рис. З. Яичниковая ветвь (стрелка) левой маточной артерии, изолированно кровоснабжающая левый придаток (двойная стрелка)
Помимо маточной и яичниковой артерии, источником кровоснабжения правого яичника может являться аппендикулярно-яичниковая артерия (a. appendiculoovarica) (рис. 4). Эта артерия идет в связке с одноименным названием, образуя анастомоз между яичниковой артерией и артерией, питающей червеобразный отросток. Зачастую от устья маточной артерии отходит нижняя пузырная ветвь (рис. 5), кровоснабжающая, помимо собственно стенки мочевого пузыря, еще и область пузырно-маточной клетчатки. В области перешейка матки от маточной артерии отходит влагалищная или нисходящая артерия (рис. 6) (их может быть несколько, причем их количество справа и слева также может не совпадать).
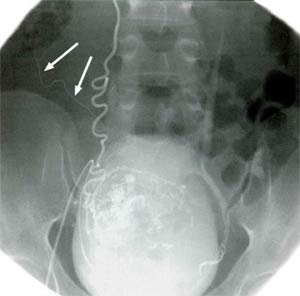
Рис. 4. Аппендикулярно-яичниковая артерия (стрелки), анастомозирующая с правой яичниковой артерией
В большинстве случаев для ЭМА используется доступ через правую общую бедренную артерию. Лишь в 1,5% случаев трудности катетеризации одной из маточных артерий заставляют прибегать к пункции контралатеральной бедренной артерии. P. Nikolic et al. [2] предлагают изначально использовать двухстороннюю пункцию бедренных артерий с последующей симультанной катетеризацией правой и левой маточных артерий. По мнению авторов, это позволяет снизить продолжительность работы флюороскопии и уменьшить рентгеновскую дозу, получаемую пациентом. С нашей точки зрения, недостатками этой методики являются повышенная травматичность и увеличение риска развития локальных осложнений. Кроме того, необходимость использования двойного набора инструментария и одновременная занятость двух эндоваскулярных хирургов существенно повышает стоимость вмешательства.
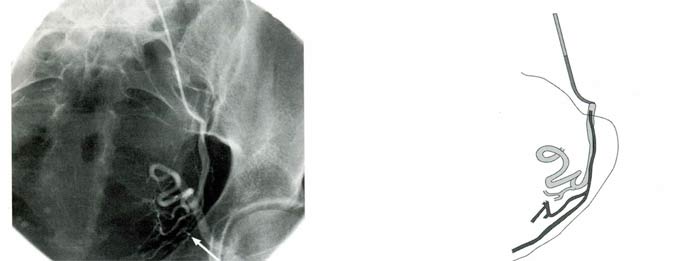
Рис. 5. Нижняя пузырная ветвь маточной артерии (стрелка), кровоснабжающая мочевой пузырь
Применение подмышечного или плечевого доступа в обычной ситуации, по всей видимости, является неоправданным в связи со значительно большей вероятностью развития локальных осложнений. Нам кажется, что такой доступ можно использовать только у больных с атеросклеротическими поражениями подвздошно-бедренного сегмента или с выраженной извитостью подвздошных артерий.
Катетеризация маточных артерий может быть выполнена с помощью различных катетров:
1) катетеров Cobra (или его аналогов),
2) катетеров Roberts Uterine Curve и
3) по коаксиальной методике с использованием проводящих катетеров и микрокатетеров [3].
Каждая из этих методик имеет характерные технические особенности.
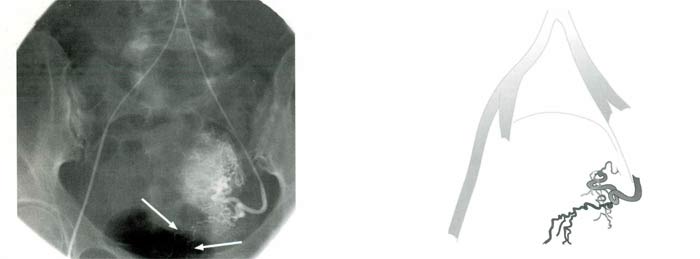
Рис. 6. Влагалищные ветви маточной артерии (стрелки)
Наиболее часто используют катетер Cobra 4–5 F с диаметром кривизны С2, длиной 65–90 см, реже — катетеры с похожей конфигурацией кончика (Levin, Judkins Right и др.). Первоначально катетер проводят до уровня бифуркации аорты и далее в контралатеральную общую подвздошную артерию. После этого вводят гидрофильный проводник, который размещают во внутренней подвздошной артерии. По проводнику низводят катетер, а затем вращательными движениями стремятся направить его кончик в устье маточной артерии, контролируя это тестовыми инъекциями контрастного вещества.
При наличии острой бифуркации аорты, затрудняющей «перекидывание» катетера в контралатеральную подвздошную артерию, целесообразно формирование так называемой петли Waltman. Для этого катетер Cobra 4-5 F вводят в одну из висцеральных ветвей брюшной аорты (предпочтительно почечную артерию) на глубину 3–5 см. Усилив аортальную часть катетера проводником, выполняют одновременное поступательное и вращательное движение комплекса «катетер-проводник». При этом в области устья катетеризированного сосуда происходит складывание катетера в виде своеобразной петли, которая при дальнейшем движении кверху вытягивает его кончик в аорту. Сформированный в аорте в виде петли Waltman катетер осторожно низводят вниз, направляя его кончик в устье контралатеральной общей, а затем внутренней подвздошной артерии (рис. 7). В дальнейшем вращательными и одновременно маятникообразными движениями петли катетера его кончик размещают в маточной артерии.
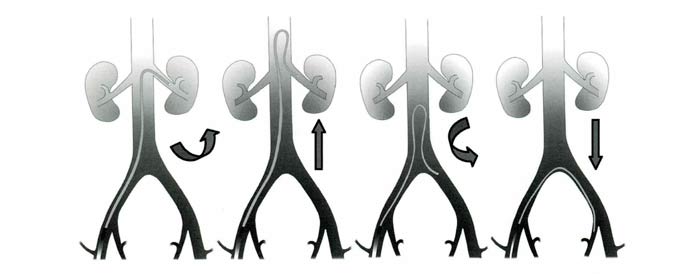
Puc. 7. Этапы формирования петли Waltman через почечную артерию катетером Cobra для катетеризации контралатеральной маточной артерии (объяснения в тексте)
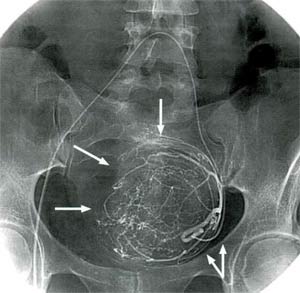
Рис. 8. Катетер установлен в L-образном изгибе маточной артерии (двойная стрелка), отчетливо контрастируются сосуды перифиброидного сплетения (стрелки)
В ряде случаев извитость маточной артерии не позволяет свободно провести катетер. В такой ситуации рекомендуется ввести проводник и осторожными движениями попытаться «расправить» им сосуд и придать ему прямую конфигурацию. Успех подобной манипуляции обеспечивается тем, что проксимальные участки ствола маточной артерии располагаются в параметрии и не фиксированы в окружающих тканях. Поэтому они могут относительно свободно смещаться и разгибаться. После установки катетера выполняют артериографию маточной артерии, которая необходима для верификации положения катетера, определения необходимого диаметра эмболизационного препарата и анатомических особенностей (в первую очередь, обнаружения анастомозов между маточной и яичниковой артериями). Для обеспечения безопасности последующей ЭМА, предотвращающей ретроградный выброс эмболизационного препарата в близлежащие ветви внутренней подвздошной артерии, желательно довести кончик катетера до уровня L-образного изгиба маточной артерии (рис. 8).
После эмболизации контралатеральной маточной артерии в аорте вновь формируют петлю Waltman, с помощью которой катетеризируют ипсилатеральную маточную артерию и производят ее эмболизацию (рис. 9). Накопленный нами опыт позволил выявить недостатки методики катетеризации катетерами типа Cobra, связанные с их недостаточной управляемостью и частым возникновением перегибов (кинкинг-эффект), что, в конечном итоге, существенно усложняло вмешательство.
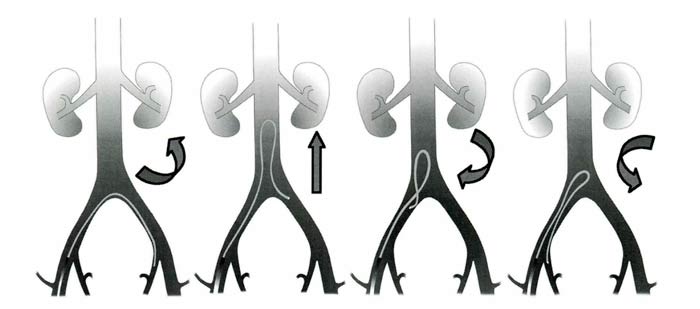
Рис. 9. Формирование петли Waltman катетером Cobra для катетеризации ипсилатеральной маточной артерии через подвздошную артерию (объяснения в тексте)
Этот катетер был специально разработан для эмболизации маточных артерий. Он имеет характерную форму фабрично заданной петли Waltman, оснащенную в месте изгиба усиливающим рентгеноконтрастным маркером. Несущая армированная часть катетера диаметром 5 F обладает повышенной жесткостью, предотвращающей его непреднамеренные перегибы, а мягкая дистальная часть с перепадом диаметра до 4 F, имеющая изогнутый кончик, облегчает зондирование ветвей внутренней подвздошной артерии, обнаружение и катетеризацию ствола маточной артерии. Методика применения катетера Roberts имеет свои особенности. Для формирования петли катетера Roberts необходимо предварительно катетеризировать контралатеральную общую, а затем наружную подвздошную артерию с помощью катетера Cobra или его аналогов, методика которой описана выше. После этого катетер Cobra удаляют и по проводнику вводят катетер Roberts до тех пор, пока маркер на его изгибе не достигнет уровня бифуркации аорты. Проводник извлекают, и поступательным движением придают катетеру необходимую форму.
Дальнейшая методика катетеризации маточных артерий и их эмболизации практически не отличается от описанной выше техники манипуляции катетером Cobra, сформированным в виде петли Waltman (рис. 10). С нашей точки зрения, катетер Roberts, благодаря его хорошей управляемости и гибкости дистальной части, является идеальным для катетеризации и эмболизации маточных артерий.
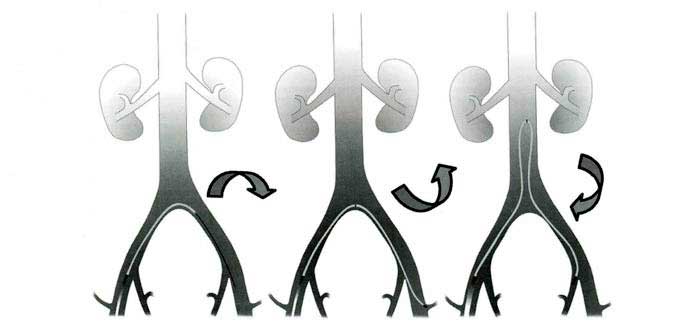
Рис. 10. Методика формирования петли катетера Roberts
Самой передовой методикой ЭМА является ее выполнение через микрокатетеры, подведенные суперселективно к ветвям маточной артерии, непосредственно питающим миоматозные узлы. Для этого во внутренние подвздошные артерии по описанной выше методике введения катетера Cobra устанавливают j-моделированные проводящие катетеры. Через них проводят систему коаксиальных гидрофильных микрокатетеров и микропроводников, которые вводят максимально глубоко в дистальный отдел ствола маточной артерии. Выполняют суперселективную артериографию маточных артерий введением 10 мл контрастного вещества с записью видеоизображения со скоростью 10–15 кадров в секунду. Благодаря этому определяют ветви маточной артерии, доминирующие в кровоснабжении миоматозного узла.
Поступательными и вращательными движениями размещают кончик микрокатетера в патологическом сосуде, и затем производят его суперселективную эмболизацию. Наш опыт позволил установить, что подобная методика обладает не только рядом преимуществ, но и недостатков. Положительными факторами являются, во-первых, практически полное отсутствие негативного влияния ЭМА на кровоснабжение неизмененных тканей матки и миометрия, во-вторых, устранение потенциальной угрозы попадания эмболов в ткань яичников при наличии выраженных маточно-яичниковых артериальных анастомозов, в-третьих, критическое уменьшение выраженности болевого компонента постэмболизационного синдрома, в-четвертых, минимизация дозы эмболизационного препарата с соответствующим экономическим эффектом. Негативная сторона суперселективной ЭМА связана, во-первых, с повышенной сложностью вмешательства, во-вторых, с увеличенным временем и дозой облучения пациенток, в-третьих, с необходимостью применения сложных и дорогостоящих инструментов. Однако мы считаем, что у пациенток с единичными миоматозными узлами, особенно заинтересованных в беременности, подобная методика должна рассматриваться как метод выбора.
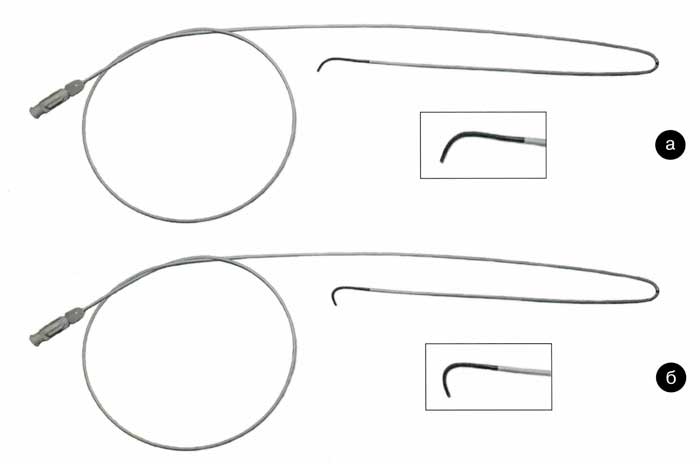
Рис. 11. Стандартный (а) и модифицированный (б) катетер Roberts оригинальной конфигурации (объяснения в тексте)
Как правило, выполнение эмболизации маточных артерий не представляет сложности для опытного эндоваскулярного хирурга. Тем не менее, в ряде ситуаций, успешное выполнение вмешательства может быть затруднено. К ним, в первую очередь, следует отнести особенности отхождения маточной артерии и ее спазм.
Наибольшие проблемы в процессе катетеризации маточной артерии возникают при ее отхождении от внутренней подвздошной артерии под прямым или тупым углом. В такой ситуации катетеризацию маточной артерии удобнее выполнять в косой проекции. Это позволяет избежать проекционного наложения устья маточной артерии на другие ветви внутренней подвздошной артерии, а также увидеть ствол маточной артерии под углом, удобным для визуального контроля. Целесообразно также использовать функцию ангиографического аппарата roadmaping.
Зачастую добиться успешной катетеризации маточной артерии, отходящей под тупым углом, позволяет применение специальной модификации катетера Roberts, имеющей резкий изгиб в виде крючка на расстоянии 4–5 мм от его кончика по дуге с радиусом 1 -2 мм (рис. 11, а, б). Такая конфигурация дает возможность «зацепить» крючком катетера устье маточной артерии (рис. 12, а, б) и добиться его устойчивого положения. Дальнейшее низведение моделированного таким образом катетера Roberts в ствол маточной артерии можно производить только по гидрофильному проводнику для устранения риска перфорации сосуда резко изогнутым кончиком катетера.
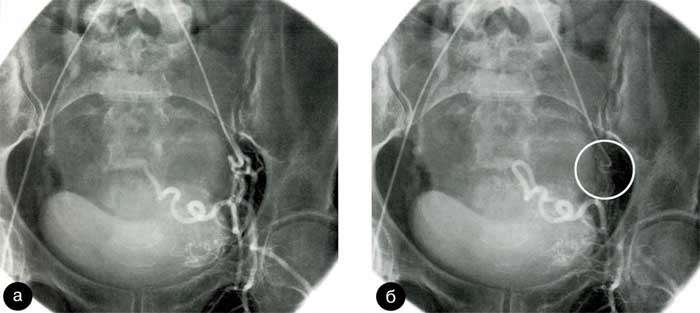
Рис. 12. Использование модифицированного катетера Roberts: a) - резкий изгиб маточной артерии у устья, б) - катетер оригинальной конфигурации установлен в сосуде (отмечен кругом)
Спазм маточной артерии, как правило, возникает в устье и проксимальной части ствола сосуда при выполнении катетеризации резко извитой артерии. Попытки насильственного введения проводника или катетера в подобной ситуации потенциально опасны перфорацией стенки артерии с появлением экстравазации контрастного вещества (рис. 13, а, б, в). В ряде случаев это осложнение ведет к формированию ограниченной гематомы между стенкой матки и мочевого пузыря, что сопровождается специфическими рентгеноангиологическими (рис. 14, а, б) и ультразвуковыми признаками. Как правило, паравезикальная гематома незначительных размеров не требует хирургического лечения. Однако для предотвращения увеличения ее объема необходимо использовать локальное воздействие гипотермии (пузыри со льдом на нижние отделы живота, или внутривлагалищно) и проводить гемостатическую терапию.
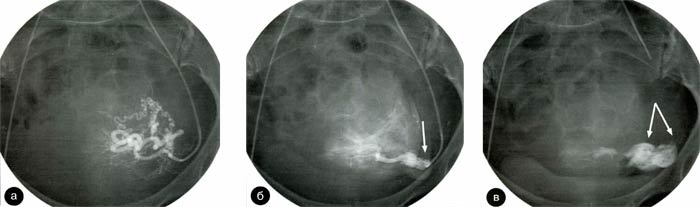
Рис. 13. Перфорация ствола маточной артерии с экстравазальным поступлением контрастного вещества;
а)- селективная ангиограмма левой маточной артерии до эмболизации,
б)- появление экстравазации контрастноговещества в процессе введения эмболизационного препарата (стрелка),
в)- обширное экстраазальное контрастное пятно после вмешательства и удаления катетера из сосуда (двойные стрелки)
При возникшем спазме ствола маточной артерии нежелательно производить введение эмболизационного препарата от устья сосуда, поскольку в спазмированном участке может произойти агрегация частиц эмболизата с последующим развитием лишь локального тромбоза артерии, имитирующем техническую успешность эндоваскулярного вмешательства. Очевидно, что при этом само перифиброидное сплетение в большинстве случаев остается неэмболизированным, дискредитируя в конечном итоге эффективность метода. Для устранения спазма мы рекомендуем ввести в маточную артерию 5–10 мл 0,1% раствора папаверина и выждать в течение 5–7 мин. Если спазм не разрешается, целесообразно перейти к эмболизации контралатеральной маточной артерии (если она еще не выполнялась), а затем вернуться к спазмированному сосуду. В ряде случаев при сохранении спазма маточной артерии допускается выполнение ЭМА эмболизационным препаратом минимального калибра (150–200 мкм), частички которого могут беспрепятственно преодолеть зону спазма. И, наконец, можно попытаться провести через зону спазма гидрофильный микропроводник и микрокатетер, и использовать их для введения частиц поливинилалкоголя (ПВА).
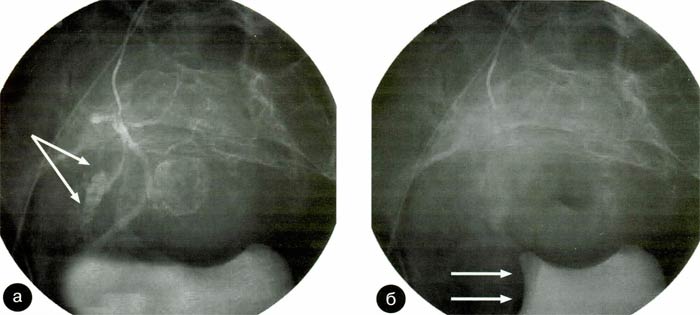
Рис. 14. Образование перипузырной гематомы после перфорации маточной артерии;
а)- экстравазация контрастного вещества (указана двойной стрелкой),
б)- рентгенологические признаки сдавления мочевого пузыря гематомой (параллелные стрелки)
Между яичниковой ветвью маточной артерии и собственно яичниковой артерией в 78% наблюдений существует прямое анастомозирование. Выделяют три вида маточно-яичниковых артериальных анастомозов (рис. 15). Параметры кровотока в этих сосудистых соустьях предопределяют специфическую технику и тактику применения ЭМА.
При 1 типе анастомозов в кровоснабжении матки и миомы принимают участие как маточная, так и собственно яичниковая артерия. 1-а подтип предполагает приоритетный кровоток по маточной, а 1–6 подтип — по яичниковой артерии. Следующий, 2-й тип анастомозов обусловлен анатомической особенностью изолированного кровоснабжения яичника только из одноименной ветви маточной артерии. И, наконец, 3-й тип анастомозирования включает отдельное кровоснабжение верхней и нижней части матки и миомы через яичниковую и маточную артерии.
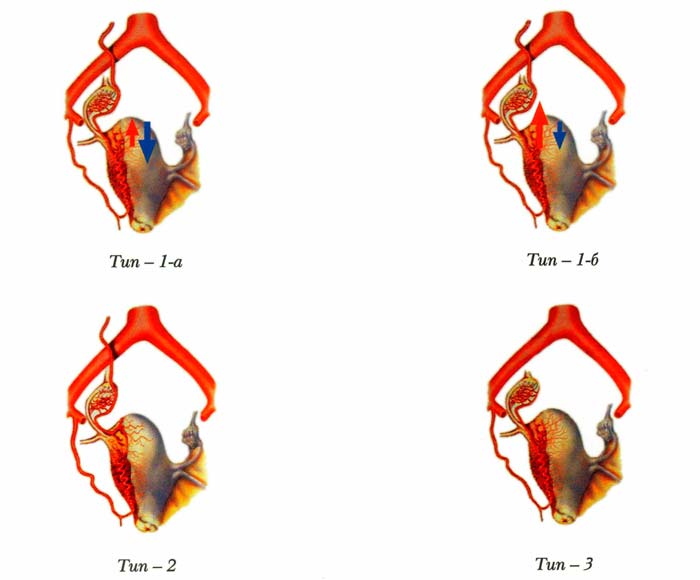
Рис. 15. Варианты кровоснабжения матки и миомы (объяснения в тексте) (Radiology 2002, Vol. 224, N 3, р.707-712)
При 1 -а типе кровоснабжения в маточную артерию требуется вводить эмболизационный препарат в виде частиц как можно более малого диаметра (желательно 300 мкм), под высоким давлением с большой скоростью. Это обусловлено тем, что мощный кровоток по собственно яичниковой артерии, достигающий сосудов перифиброидного сплетения, гидродинамически препятствует попаданию эмболов, вводимых в маточную артерию, во все ветви перифиброидного сплетения. При неправильном выборе большого размера частиц ПВА (более 500 мкм), и недостаточно быстром и сильном введении взвеси происходит агрегация в сосудах большого калибра, и создается так называемый бифуркационный сладж, имитирующий тотальную закупорку ствола маточной артерии и кажущуюся эффективность вмешательства (рис. 16, а, б, в).
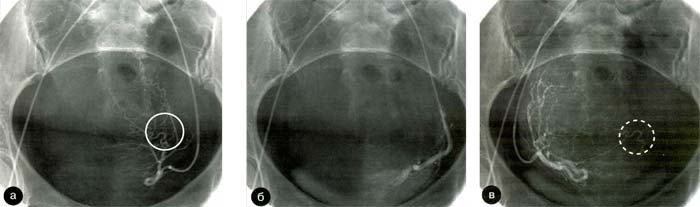
Рис. 16. «Псевдоэмболизация» перифиброидного сплетения;
а) — ангиограмма левой МА до эмболизации (кружком отмечен извитой
участок сосуда),
б) — ложная «полная» окклюзия сосуда,
в) — появление контрастирования сосудов перифиброидного сплетения через контрлатеральую правую маточную артерию (пунктирным кружком отмечен тот же участок
В тоже время, периферические артериальные ветви, питающие миому, остаются полностью проходимыми, и начинают получать усиленное кровоснабжение из собственно яичниковой артерии. В результате этого частично или полностью исчезает необходимый клинический эффект от ЭМА, что в конечном итоге дискредитирует метод лечения, а, зачастую, требует дополнительных эндоваскулярных операций — эмболизации яичниковых артерий. Необходимо обратить внимание на сложность выявления 1-а типа кровоснабжения по данным ангиографического исследования, поскольку заполнить контрастным веществом яичниковую артерию из ствола маточной артерии через анастомоз против тока крови практически невозможно. Единственным эндоваскулярным признаком, позволяющим лишь предположить наличие такого типа кровоснабжения, является регистрация слабого и трудноуловимого «размыва» контрастного вещества в одном из отделов маточной артерии.
Достоверно верифицировать 1-а тип кровоснабжения удается лишь при тщательном дуплексном ультразвуковом сканировании маточной и яичниковой артерий и их ветвей. Следует подчеркнуть, что при 1-а типе кровоснабжения риск попадания эмболов в сосуды яичника против мощного тока крови по собственно яичниковой артерии практически полностью отсутствует.
Следующий, 1–6 тип кровоснабжения, как правило, легко выявляется во время стандартного ангиографического исследования маточных артерий, при котором контрастное вещество заполняет не только сосуды перифиброидного сплетения, но и поступает против слабого тока крови по собственно яичниковой артерии и заполняет артериальную сеть яичника. Эти особенности гемодинамики предопределяют нюансы техники ЭМА, при которой целесообразно использовать частицы ПВА большего диаметра (более 500 мкм). Причем вводить их следует с малой скоростью, под небольшим давлением, и, желательно, дискретно малыми порциями. При этом крайне важно тщательно следить за распространением эмболизирующей взвеси по сосуду и своевременно определять «конечную точку» эмболизации.
Чрезмерно быстрое введение эмболизата приводит к первоначальной закупорке патологических сосудов, питающих миому, в результате чего резко возрастает периферическое сосудистое сопротивление с перераспределением кровотока в сторону яичниковой артерии. Учитывая этот гемодинамический фактор, дальнейшая инъекция избыточного объема эмболизирующей смеси приводит к ее непреднамеренному забросу в артериальную сеть яичника. Это осложнение в большинстве случаев может быть выявлено сразу после ЭМА во время контрольных ангиографических исследований, при которых в случае неадекватно проведенного эндоваскулярного вмешательства рентгеноконтрастное вещество вместе с частицами эмболизирующего вещества активно накапливается в сосудах яичника и длительно сохраняется в его строме (рис. 17, а, б).
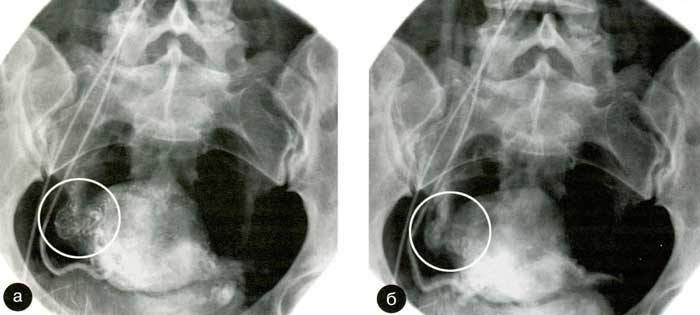
Рис. 17. Некорректная ЭМА при I-б типе кровоснабжения;
а)- контрастирование артериальной сети правого яичника из маточной артерии,
б)- после ЭМА накопление частиц ПВА и контраста в сосудах яичника
Аналогичная проблема при ЭМА также может отмечаться и при 2 типе кровоснабжения, когда артериальное питание яичника осуществляется только за счет единственного сосуда, отходящего от маточной артерии (г. ovarici a. uterinae). При этом собственно яичниковая артерия либо рудиментарно неразвита, либо полностью отсутствует.
Как правило, 2 тип кровоснабжения сразу же выявляется во время проведения диагностической артериографии матки. В таких ситуациях от выполнения эндоваскулярного вмешательства следует отказываться из-за большого риска развития ишемического поражения яичника, особенно у пациенток репродуктивного возраста, желающих иметь детей, и когда целью ЭМА является восстановление фертильности.
Исключения можно допускать в тех случаях, когда имеется сочетание следующих факторов:
Также оправдано выполнение ЭМА при 2 типе кровоснабжения в ургентнои ситуации для остановки профузного маточного кровотечения, когда другие методы лечения невозможны или сопряжены с реальной угрозой жизни больной. Частичная или полная эмболизация артериальных ветвей яичника не всегда сопровождается его ишемическим поражением, особенно при наличии дополнительных источников кровоснабжения 1 типа. Однако, по данным N. Stringer et al. (2000) и J. Payne et al. (2002) [4, 5] негативными последствиями указанного осложнения могут являться развитие аналога постгистерэктомического синдрома, нарушение репродуктивной функции, транзиторная или стойкая яичниковая аменорея. И, наконец, при 3 типе кровоснабжения клинический эффект от ЭМА может быть невыраженным или полностью отсутствовать, поскольку микросферы эмболизирующего препарата попадают в сосуды лишь одного из полюсов миоматозного узла, в то время, как его большая часть продолжает получать активное кровоснабжение из собственно яичниковой артерии. Выявить 3 тип кровоснабжения в процессе ЭМА достаточно сложно. Его наличие можно лишь предположить при обнаружении несоответствия слабо выраженных сосудов перифиброидного сплетения, занимающих поверхность, уступающую объему и площади поперечного сечения миоматозного узла, предполагаемой по данным УЗИ. Достоверную картину 3 типа кровоснабжения позволяет установить контрольное ультразвуковое исследование, произведенное после эндоваскулярного вмешательства, в результате которого можно убедиться в сохранении активного кровоснабжения миомы в условиях полной закупорки маточных артерий. Верификация этих данных, как правило, проводится во время повторных ангиографических исследований собственно яичниковых артерий, в результате которых нередко принимается решение о необходимости дополнительного эндоваскулярного вмешательства на указанных сосудах [5–7].
Особенности техники эмболизации яичниковых артерий будут подробно изложены в следующих публикациях, посвященных повторным эндоваскулярным вмешательствам. Однако, хотелось бы отметить, что стремление к симультанной эмболизации маточных и яичниковых артерий кажется нам не совсем оправданным, поскольку в большинстве случаев 3 тип кровоснабжения является односторонним, и совокупная традиционная ЭМА обеих маточных артерий может привести к необходимому клиническому эффекту. По всей видимости, к попыткам дополнительной катетеризации и эмболизации яичниковых артерий целесообразно прибегать спустя 3–6 месяцев после ЭМА и лишь в случае явной клинической неэффективности первичного вмешательства.
С нашей точки зрения, тщательное изучение рентгеноанатомии артерий матки и яичников, возможных вариантов кровоснабжения этих органов, детализация методики ЭМА, разработка новых инструментов и освоение технических приемов, необходимых для успешного выполнения эмболизации при нестандартных клинических ситуациях, в конечном итоге, будут способствовать обеспечению максимальной безопасности и эффективности этого лечебного вмешательства. По всей видимости, к выполнению ЭМА должны допускаться лишь опытные эндоваскулярные хирурги, обладающие большим опытом селективной и суперселективной катетеризации висцеральных сосудов и прошедшие дополнительное обучение основам гинекологии.
MODERN ASPECTS OF UTERINE ARTERY EMBOLIZATION PART 2: METHODICAL ASPECTS
B. Y. Bobrov, S. A. Kapranov, v. G. Breusenko,
Y. E. Dobrohotova, I. A. Krasnova, v. B. Aksenova, D. G. AryutinThe minute methodical details and technical aspects of uterine arteries embolization, crucial for successful intervention, are reviewed in this article. The text provides detailed descriptions of roentgen anatomy of the internal iliac arteries, different variants of blood circulation in uterus and ovaries and various types of anastomozes between uterine and ovarian arteries. The techniques indispensable for successful embolization of uterine arteries in complex anatomic cases and in peculiar ways of uterine arteries formation are thoroughly described.
Key words: uterine arteries embolization, uterine myoma, uterine arterio-arterial anastomoses.
1. Pelage J., Le Dref О., Soyer P. et al. Arterial anatomy of the female genital tract: variations and relevance to transcatheter embolization of the uterus, AJR. 1999; 172: 989 — 994.
2. Nikolic В., Spies J., Campbell L. et al. Uterine artery embolization: reduced radiation with refined technique,/ Vase. Intervent. Radiol. 2001; 12: 39 — 44.
3. Капранов С.А., Бреусенко В.Г., Бобров Б.Ю.и соавт. Применение эмболизации маточных артерий при лечении миомы матки: анализ 258 наблюдений. Международный журнал интервенционной кардиоангиологии. 2005; 7: 56.
4. Stringer N., Grant Т., Park J., Oldham L. Ovarian failure after uterine artery embolization for treatment of myomas./ Am. Ass. Gynecol. Laparosc. 2000; 7(3): 395 -400.
5. Payne J., Robboy S., Haney A. Embolic microspheres within ovarian arterial vasculature after uterine artery embolization. Obstet. Gynecol. 2002; 100 (5): 883 — 886.
6. Barth M., Spies J. Ovarian artery embolization supplemeriting uterine embolization for leiomyomata. J. Vase. Interv. Radiol. 2003; 14 (9): 1177–1182. 7.
7. Pelage J, Walker W., Le Dref O, Rymer R. Ovarian artery: angiographic appearance, embolization and relevance to uterine fibroid embolization. Cardiovasc. Interv. Radiol. 2003; 26(3): 227–233.
Список литературы:
Ведущие специалисты
Наши услуги
Регистрация